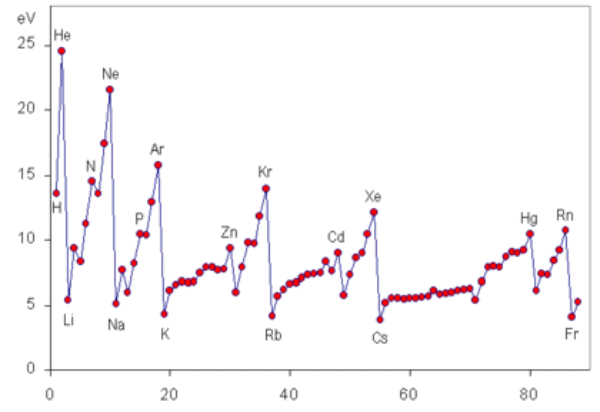
| D01 原子と分子の構造と性質 この問題の努力目標 全て覚える 技術士試験の問題からは必要最小限の引用にとどめる。(問題)が記されている部分はその引用である。 問題および解答は日本技術士会のホームページより必要に応じて入手してください。 技術士第一次試験の問題 問題番号が赤字のものは、ボーナス問題 原子の構成 H28年 Ⅰ-4-2 周期律と物性 H18年 Ⅰ-4-1 水素の性質 H16年 Ⅰ-4-4 ハロゲンの性質 H21年 Ⅰ-4-1 分子の構成元素 H16年 Ⅰ-4-3 分子の形 H22年 Ⅰ-4-1 価電子の数 H17年 Ⅰ-4-2 化学結合の種類 H17年 Ⅰ-4-1 原子の構成 H28年 Ⅰー4-2 正答: ④ (解答) 元素記号の左横に2つの数字が並ぶが、下が原子番号、上が質量数である。 原子番号は陽子の数、質量数は陽子+中性子の数、そして原子が中性である(荷電していない)ならば電子の数=陽子の数である。 ① 40-20≠40-18 ② 35-17≠37-17 ③ 全くの無関係 ④ 電子の数=陽子の数=原子番号 従って、17=17は正しい。 ⑤ これを同位体という。同素体とは、たとえば炭素でいうと、グラファイト、ダイヤモンド、フラーレンの関係。 周期律と物性 H18年 Ⅰ-4-1 正答: ④ (解答) 「原子番号が1つ増すと,原子量も同様に1つ増える。」は誤り。 原子量は12Cを基準に決められた質量の相対値であるので、実数であって整数とは限らない。 同位体が存在するので、このルールは当てはまらない。例えば、1H→3He、1H→4Heなど。 「最も左の列に属するアルカリ金属には,イオン化エネルギーが大きなものが多い。」は誤り。 「原子番号が近接している非金属元素同士は,その化学的性質が類似している。」は誤り。 縦の列が同じ元素同士は価電子数が等しく,化学的性質が類似しているものが多い。 「常温において固体の元素は,原子番号が大きくなるほど,密度が増大する傾向にある。」は誤り。 水素分子は、常温常圧で無色無臭の気体である。 水素イオンは、常温常圧の水中で平衡によって生じる。 水素原子は、水分子の構成要素であり、酸素原子1個に対して2個結合している。 水素原子には、質量数1、2及び3のものが存在し、いずれも陽子1個を含む。 「水溶液中の水素分子の濃度の指標として、pHが用いられる。」は誤り。 ハロゲン原子の電気陰性度は大きいものからF、Cl、 Br、Iの順である。
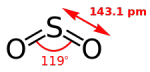
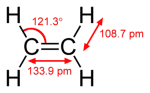
相手から電子を取る力 相手は酸化される 2.HCl、HBr、HIのpKa値は英語版Wikipediaから得た 分子の構成元素 H16年 Ⅰ-4-3 正答: ① (解答) フラーレン C60、 酸化チタン(Ⅳ) SiO2、メタノール CH3OH、 石灰岩 CaCO3、 石英ガラス SiO2 石灰岩(Wikipedia) 炭酸カルシウム(CaCO3、方解石または霰石)を50%以上含む堆積岩。 大理石(Wikipedia) 大理石(だいりせき)とは、石灰石を源岩とする変成岩(結晶質石灰岩)の石材としての一般的な呼称である。大理石は古代より建築や彫刻に使われている。 炭素の同素体には(炭素、Wikipedia) ダイヤモンド、グラファイト、ロンズデーライト、フラーレン、カーボンナノチューブがその構造の図示と共に特徴が記載されている。 分子の形 H22年 Ⅰ-4-1 正答: ④ (解答) 分子の形と分子の極性(双極子モーメント)をWikipediaより抜き出した。分子が対称性を持っていればその分子に極性はない。二酸化硫黄(SO2)は曲がった構造をしているので、分子が極性を持っている。 分子の持つ極性は双極子モーメントで表され、その単位はデバイ(Debye、10-18esu・cm)である。大きさ4.80×10-10esu(電子の持つ電荷)の二つの電荷が0.1nm(1Å)の距離はなれているとき、4.80×10-18esu・cm(4.80デバイ)の双極子をもつという
価電子の数 H17年 Ⅰ-4-2 正答: ② (解答)
電子殻内に入る電子数は、K殻が2個、L殻が8個、M殻が18個です。原子番号が増えるにつれ、電子化K殻、L殻、M殻と電子が順番に埋まっていき、このK殻とL殻の合計で10個までの電子を収容することができます。示された元素記号の左下に振られているのが原子番号です。元素を構成する陽子の数を表しています。元素が中性であればこの陽子と同じ数の電子が存在します。M殻上に存在する電子の数は、 M殻上の電子の数=原子番号-10-価電数
で計算します。
となります。 化学結合の種類 H17年 Ⅰ-4-1 正答: ⑤ (解答) イオン結合 - 静電引力 - 塩化ナトリウム 共有結合 - 共有電子対 - 二酸化ケイ素 金属結合 - 自由電子 - カルシウム 水素結合 - 極性 - フッ化水素 「配位結合 - 非共有電子対 - グラファイト」は誤り。 原子、イオン、分子間(場合によっては、同一分子の中の異なる原子団の間)に働く引力または反発力[2]の中で、次に挙げる物理的起源をもつ相互作用のものを総称する。 グラファイト(Wikipedia)
問題一覧表へ戻る |